TORBEN INGEMANN PETERSEN, PAHLE EINAR, THORBJØRN SOMMER et THOMAS ZILLING
Département De Chirurgie, Aarhus Université Hôpital, Aarhus, Danemark
Résumé.Contexte: Il n'y a que peu de rapports sur la gastrectomie totale par une approche chirurgicale laparoscopique. Une explication est la peur des complications dues à la déhiscence anastomotique dans l'anastomose œsophagojejunale connue pour entraîner une morbidité et une mortalité élevées. L'introduction d'agrafeuses a contribué à rendre l'anastomose plus sûre et plus facile à réaliser et a facilité une chirurgie laparoscopique plus avancée. En chirurgie ouverte, la plupart des chirurgiens utilisent une agrafeuse circulaire pour l'anastomose œsophagojejunale ou une technique suturée à la main. Les deux techniques sont difficiles à utiliser en chirurgie laparoscopique, surtout si l'œsophage est étroit. Pour faciliter la création d'anastomoses œsophagojejunal, nous avons adopté une technique avec une anastomose agrafée linéaire. Notre méthode est basée sur une technique d'agrafage où l'œsophage est divisé au-dessus du cardia gastrique suivi d'une œsophagojejunostomie réalisée avec la nouvelle GIA-60 Endo de Covidien™Agrafeuse ultra universelle. L'ouverture résiduelle est fermée avec une suture réabsorbable 3-0. Patients et méthodes: De juin 2009 à mai 2012, 14 hommes et 16 femmes (âge médian = 66 ans, fourchette = 39-84 ans) ont subi une gastrectomie totale laparoscopique due à un cancer gastrique. Résultats: un patient est décédé pendant son séjour à l'hôpital; correspondant à une mortalité postopératoire de 3,3%. Une fuite dans l'anastomose de l'œsophagojejunal est survenue chez trois patients (10%). Deux des patients présentant une fuite dans l'anastomose œsophagojejunale avaient une fuite supplémentaire de bulbe duodénal, qui aurait pu provoquer une déhiscence anastomotique. Les patients ont eu un séjour postopératoire médian à l'hôpital de six jours (plage = 3 à 156 jours). Six patients ont subi une réopération en raison de complications, y compris une application de stent endoscopique dans l'anastomose. Conclusion: même si un taux de fuite de 10% peut être considéré comme élevé, cette étude décrit une méthode simple pour effectuer une œsophagojejunostomie après une gastrectomie par une approche laparoscopique indépendamment de la largeur de l'œsophage. Cette étude montre également que la gastrectomie laparoscopique peut être réalisée à des stades plus avancés du cancer gastrique.
Correspondance À:Torben Ingemann Petersen, MD, Département de gastroentérologie chirurgicale L, Hôpital universitaire d'Aarhus, Nørrebrogade 44, DK 8000 Åarhus C, Danemark. Tel: + 45 78463889,
Fax: + 45 78462840 e-mail: torbpete@rm.dk
Clé Mots: Gastrectomie totale, cancer gastrique, anastomose œsophagojejunale, dispositifs d'agrafage, technique chirurgicale mini-invasive.
0250-7005/2013 2.00 $ +.40
Depuis le premier rapport en 1994 par KitanoEt coll. De la gastrectomie distale assistée par laparoscopie pour le cancer gastrique (1), plusieurs cas ont été signalés, principalement réalisés au Japon et en Corée. Malgré l'augmentation exponentielle par an du nombre d'actes laparoscopiques réalisés (2), son acceptation par rapport à la procédure ouverte reste controversée. Malgré l'expérience et l'activité laparoscopiques croissantes, la gastrectomie laparoscopique reste une procédure expérimentale, presque exclusivement réservée au cancer gastrique précoce et, pour la faisabilité technique, principalement réalisée sous forme de résection gastrique distale laparoscopique (3). L'approche laparoscopique des cancers gastriques plus avancés reste à étudier plus avant et la procédure doit encore acquérir une acceptation plus large, même parmi les laparoscopistes qualifiés et expérimentés. L'œsophagojejunostomie n'est pas facile à réaliser, surtout si l'œsophage est étroit. En chirurgie ouverte, une agrafeuse circulaire est souvent utilisée ou une technique suturée à la main. Ces techniques ne sont pas faciles à utiliser en laparoscopie, même s'il existe un nouveau dispositif, OrVil™(Covidien, Mansfield, MA 02048, USA), où la cartouche de l'agrafeuse circulaire est connectée à une sonde gastrique pour faciliter l'intubation de l'oesphage par la bouche du patient. Outre les problèmes techniques impliqués dans l'oesphagojejunostomie, il y a une discussion sur l'adéquation oncologique: Est-il possible d'obtenir une résection R0 et d'obtenir au moins le même nombre élevé de ganglions lymphatiques récédés que iN chirurgie ouverte? (4) . Deuxièmement, même si quelques essais cliniques randomisés ont comparé la laparoscopieVersus Gastrectomie ouverte, des essais prospectifs randomisés à grande échelle avec des données de survie à long terme restent à réaliser (5, 6). Enfin, l'approche laparoscopique est complexe et implique une longue courbe d'apprentissage (2, 7). Essayer de mettre en œuvre la procédure et d'acquérir la technique prend du temps et coûte cher, notamment dans la gestion de l'apparition accrue de complications dans la phase d'apprentissage. Dans cette étude, nous présentons les résultats de notre série de gastrectomie totale laparoscopique consécutive où l'anastomose est appliquée avec un dispositif d'agrafage linéaire connu pour créer une anastomose agrafée significativement plus large par rapport au dispositif circulaire (8).
La collecte de données sur les patients a été acceptée par l'Autorité nationale danoise de la santé. Entre juin 2009 et mai 2012, 30 patients atteints d'une tumeur gastrique prouvée par biopsie ont subi une gastrectomie totale laparoscopique dans notre service. Vingt-huit patients ont eu un carcinome gastrique prouvé par biopsie et deux patients avaient un cancer métastatique de l'estomac: un patient avec un cancer du sein antérieur et une patiente avec un cancer épidermoïde antérieur dans la région oropharyngiale, tous deux atteints de métastases gastriques. Les tumeurs ont été localisées dans le tiers supérieur de l'estomac chez quatre patients, dans le tiers moyen chez 10 patients et dans le tiers inférieur de l'estomac chez 12 patients. Quatre patients avaient une lienite plastica. Tous les patients ont subi une évaluation approfondie des métastases à distance qui, si elles sont positives, ont exclu le patient de l'opération. L'évaluation préopératoire comprenait une gastroscopie avec biopsie de la tumeur, une laparoscopie et une échographie assistée par laparoscopie pour exclure la propagation aux organes adjacents et l'ensemencement péritonéal, la tomographie par émission de positons FDG et l'analyse par ordinateur. L'opérabilité comprenait un électrocardiogramme et si nécessaire des tests de la fonction cardiaque et pulmonaire. Les patients présentant un stade tumoral ≥ T2N0 ont été sélectionnés pour une chimiothérapie néoadjuvante (7). Les caractéristiques des patients sont données au tableau I.
![]() Tableau I.L'omble des patientsActéritique.
Tableau I.L'omble des patientsActéritique.
• Nombre de patients 30 (3 patients 2009, 9 patients 2010, 10 patients 2011, 8 patients 2012)
• Nombre de patients hommes/femmes: 14/16
• Âge, médian 66 ans (plage, 39-84)
• Indice de masse corporelle, médiane 23 (plage, 17-30)
• Score ASA, nombre de patients: ASA I 9, ASA II 19, ASA III 2
Technique chirurgicale.Sous anesthésie générale, le patient a été placé en décubitus dorsal avec les jambes écartées et dans une légère position tête haute. Le chirurgien placé en position française entre les jambes des patients avec l'assistant de caméra sur le côté droit du patient et l'assistant le plus expérimenté se trouvait sur le côté gauche du patient. La figure 1 montre la procédure opératoire étape par étape. Le pneumopéritoine CO2 a été induit à l'aide de canula Verres introduits dans l'hypochondre gauche. Deux ports de 5 et 12mm ont été placés en ligne juste au-dessus de l'ombilic et un rétracteur de foie de Natason a été placé au sommet de l'épigastre pour rétracter le lobe du foie gauche. À l'aide d'un laparoscope oblique avant de 30 °, la cavité péritonéale a été inspectée pour l'ensemencement péritonéal et les métastases hépatiques après une chimiothérapie préopératoire. En tenant le lobe hépatique gauche de côté, le ligament gastro-hépatique a été divisé à l'aide de ciseaux activés par ultrasons (UltraCision Harmonic Scalpel®; Ethicon Endo-Surgery, LLC, Guaynabo, Porto Rico, États-Unis) suivant les crus diaphragmatiques droit et gauche au-dessus et autour de l'œsophage, où le ligament phrénoœsophagien et les nerfs vagaux étaient divisés avec le ciseau harmonique. Le ligament gastro-colique a ensuite été divisé le long de la bordure du côlon transverse, y compris le plus grand épitum de l'échantillon à réséquer. La dissection a été suivie vers la droite jusqu'au pylore où les ganglions lymphatiques infrapyloriques et suprapyloriques (station ganglionnaire 5 et 6, respectivement) ont été inclus dans la résection. L'artère gastrique droite a été divisée à son origine de l'artère hépatique commune avec le ciseau harmonique. L'artère et la veine gastroépiploïques droites sont divisées à leur origine, là où l'artère gastroduodénale émerge derrière le pylore, soit avec des clips non résorbables, soit avec des ciseaux harmoniques. Le spécimen à réséfier a ensuite été divisé en dessous dans l'ampoule duodénale juste en dessous du pylore avec un duo Endo-Gia de 60mm™, Magazine brun, hauteur moyenne (Covidien) . Ganglions lymphatiques de la région antérieure de l'hépatoduoLe ligament denal et les ganglions lymphatiques à l'avant de l'artère hépatique commune ont ensuite été réséqués (station 8 et station 12 respectivement). La veine coronaire et l'artère gastrique gauche ont été divisées avec des clips non réabsorbables où ils émergent à la base du tronc cœliaque. Les ganglions lymphatiques le long du tronc cœliaque et le long de l'artère splénique (station 9 et station 11) ont été réséqués avec le ciseau harmonique. Les ganglions lymphatiques le long de la plus grande courbure gastrique ont été inclus dans l'échantillon réecté, y compris les ganglions lymphatiques à la plus grande courbure gastrique (stations 4a et 4b). La partie abdominale de l'œsophage a été suffisamment mobilisée pour réséquer les ganglions lymphatiques station 1 et station 2. L'œsophage intra-abdominal a été sectionné avec 60mm Endo-Gia.
Une boucle Roux-en-Y a été préparée à 30 cm sous le ligament de Treitz et anastomoséeAnte Coliques Comme une œsopha-gojejunostomie côte à côte à la paroi postérieure de l'agrafeuse a fermé la partie intra-abdominale de l'œsophage avec une Endo-Gia 60 de 60mm, hauteur moyenne. Une suture 3-0 réabsorbable non interrompue a été utilisée pour fermer l'ouverture d'accès de l'anastomose agrafée. À la fin de la reconstruction gastro-intestinale, l'anastomose a été testée pour une fuite non exposée avec du bleu de méthylène introduit dans l'anastomose à travers un tube oral trans. Cinquante centimètres distaux de l'anastomose œsophagojejunale, l'entéroanastomose distale côte à côte selon Roux a été réalisée avec un Endo-Gia 60 de 60mm, de hauteur moyenne. L'ouverture d'accès a été fermée avec une suture résorbable 3-0 ou V-lock. Lorsque les deux anastomoses ont été réalisées, la jambe biliaire de la boucle Roux-en-Y a été divisée près de l'œsophagojejunostomie avec un End-Gia de 60mm, chargeur brun, hauteur moyenne, des précautions ont été prises pour ne pas transsecter la boucle pour se rapprocher de l'œsophagojejunostomie, en évitant le tissu intestinal dévascularisé entre les deux lignes d'agrafeuse. Le spécimen a ensuite été inséré dans un sac et extrait à travers un orifice étendu. Enfin, les orifices de 12mm ont été fermés au niveau du fascia avec une suture résorbable. La peau a été fermée avec une agrafeuse de peau du corps, Appose™ULC (Covidien, Mansfield, MA, États-Unis).
Postopératoire Soins. Les patients ont eu droit à 300 ml d'eau dès le jour 0. Du jour 1 au jour 14, les patients ont eu droit à un régime alimentaire fluide. Aucun tube nasogastrique, cathéter central ou cathéter épidural n'a été utilisé. L'analgésie était limitée au système d'administration transcutanée du fentanyl et au paracétamol.
Trente gastrectomies totaux laparoscopiques ont été réalisées. En outre, deux procédures ont été converties en gastrectomie ouverte sur l'indication d'un cancer localement avancé impliquant une résection du côlon et une splénectomie dans un cas etSur l'indication de marges de résection peu claires dans l'autre cas. Les classifications pathologiques des métastases tumorales-nœud (pTNM) sont données dans le tableau II. Il est à noter qu'un tiers des résections comprennent des patients atteints de la maladie de stade IIb-III. Les résultats périopératoires de la gastrectomie totale laparoscopique sont énumérés dans le tableau III et les complications dans le tableau IV.
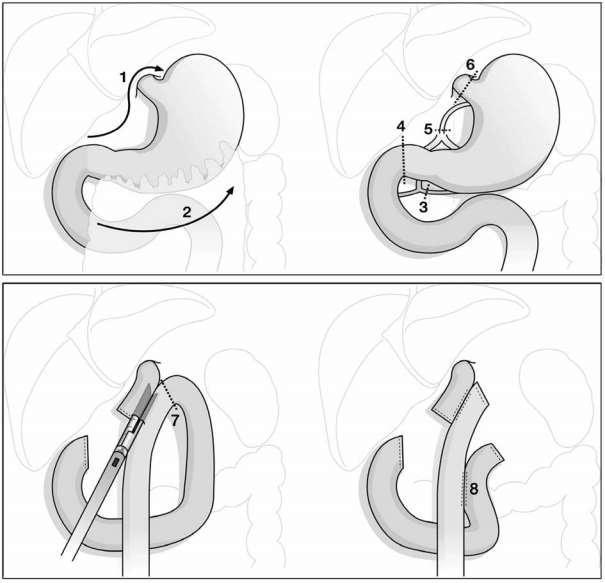
Figure 1.Illustration De Le Opératoire Procédure: 1:Division De Le Hépatogastrique Ligament. 2:Mobilisation De Le Gastrique Majeur Courbure Diviser le Gastro-colique Ligament Y compris Le Entum Dans Le Réécéré Spécimen. 3:Division De Le À droite Gastroepiploïque Artère Et Veine, Récolte Ganglions lymphatiques Station 5 Et6. 4:Division De Le Duodénal Ampoule Avec A Linéaire Agrafeuse. 5:Division De Le Coronal</Em>Veine Et Le Gauche Gastrique Artère Fermer À Le coeliaque Coffre,Récolte Lymphe Nœuds Sation8,9Et 11. 6: Résection De Le Œsophage À Le Gastro-œsophagien Jonction Dans Le Œsophage Pause.
7:Exécution Le Œsophagojejunal Anastomose Côté-À-Côté Avec 60Mm Endo-GIA. 8:Exécution Le Roux-En-Y Anastomose Côté-À-Côté Avec A60Mm Endo-GIA Environ50Cm À partir de Le Gastro-œsophagien Anastomose Sur Le Alimentaire Coffre Avant Divisant Le Biliaires Coffre Juste Ci-dessousLe Gastrojejunal Anastomose Avec Un Endo-GIA.
Il y avait quatre patients présentant des signes radiologiques ou cliniques de fuite anastomotique ou de signe de fuite de la fermeture agrafée du duodénum. Sur les trois patients présentant une fuite de l'anastomose œsophagojejunale, deux avaient également une fuite du bulbe duodénal. Un patient a eu une fuite isolée de la ligne de résection de l'ampoule duodénale. Un autre patient a été réopéré dans les heures suivant l'opération en raison d'un saignement de la ligne d'agrafeuse dans l'anastomose jejunojejunal Roux-en-Y et a été manipulé avec une application par laparoscopie d'un clip hémostatique. UnePatient a été réopéré une semaine après l'opération en raison d'une hernie de l'intestin grêle dans le hiatus œsophagien. Au total, six patients ont eu une complication majeure, dont cinq ont dû être réopérés. Une complication majeure a été traitée de manière conservatrice par l'insertion endoscopique d'un stent œsophagien recroquevillé pour fuite anastomotique. Les patients qui ont contracté une complication majeure étaient également responsables de 75% des complications mineures enregistrées.
Tableau II.Pathologique Tumeur Noeud Métastase Classification (PTNM) .
PTNM | Nombre de patients |
PT1N0M0 | 5 |
PT1N1M0 | 1 |
PT2N0M0 | 6 |
PT2N1M0 | 5 |
PT2N2M0 | 3 |
PT2N3M0 | 1 |
PT3N0M0 | 1 |
PT3N1M0 | 1 |
PT3N2M0 | 1 |
PT3N3M0 | 1 |
PT4N1M0 | 1 |
PT4N3M0 | 1 |
Cette étude montre que la gastrectomie totale mini-invasive peut également être réalisée pour des stades plus avancés du cancer gastrique, contrairement à la plupart des études précédentes où les techniques mini-invasives ont été limitées au cancer gastrique précoce (tumeurs T1-T2) dans la partie distale de l'estomac. L'approche a été la résection gastrique distale principalement en utilisant une technique assistée par laparoscopie (2, 9) . L'expérience chirurgicale du cancer plus avancé adapté à la gastrectomie totale laparoscopique a été limitée, en partie à cause du scepticisme et pour cela, il existe plusieurs raisons. Tout d'abord en raison de la nature biologique de la ca gastriqueNcer, où le nombre de métastases ganglionnaires est important pour la prédiction du pronostic.
La taille de l'échantillon dans les essais cliniques randomisés précédents a été petite. Alors même que la méta-analyse des données de ces essais cliniques randomisés a été publiée ces dernières années la polémique concernant l'innocuité en termes de complications, la chirurgie radicale (résection R0) et la survie à long terme existe toujours (3, 4, 6) . Les compétences nécessaires pour effectuer la procédure laparoscopique, la demande de chirurgiens avec une expérience de volume élevé dans la chirurgie laparoscopique. En outre, il nécessite des chirurgiens ayant une formation et un intérêt spécifiques pour la chirurgie gastrique laparoscopique et implique une longue courbe d'apprentissage (2, 10). Essayer de mettre en œuvre la procédure et d'acquérir la technique prend du temps dans la phase d'apprentissage.
Tableau III.Laparoscopique Total Gastrectomie:Résultats Sont Donné Comme Médiane avec Gamme .
Perte de sang, ml Nombre de ganglions lymphatiques dissection Temps de fonctionnement, min Séjour à l'hôpital, jours | 23 (7-53) 100 (50-650) 180 (120-330) 6 (3-156) |
Dans les données préliminaires de nos 30 premières procédures enGastrectomie totale laparoscopique présentée ici, le nombre de ganglions lymphatiques récupérés dans notre résection laparoscopique D1 est acceptable et totalement comparable à celui d'une gastrectomie ouverte (3, 11). Le nombre de ganglions lymphatiques obtenus était comparable aux données enregistrées dans le registre national danois du cancer gastrique concernant la gastrectomie totale ouverte (7). Le temps opératoire était comparable à notre expérience en chirurgie ouverte. D'une méta-analyse portant sur des patients subissant une résection D1 à D2, le temps opératoire devrait être prolongé d'environ 60 minutes, au moins, dans les résections distales laparoscopiques subissant une résection D2 (3) . Néanmoins, le temps opératoire était, d'après notre expérience, comparable à ce que l'on attend de la gastrectomie ouverte, même si cela peut être considéré comme le début de la courbe d'apprentissage. Comme prévu, la perte de sang a été limitée. L'utilisation d'un scalpel à ultrasons harmonique est cruciale pour la capacité d'effectuer une gastrectomie laparoscopique, bien que l'artère gastroépiploïque et l'artère gastrique gauche aient été divisées après la première application de clips vasculaires à la base des vaisseaux. La durée du séjour à l'hôpital a été minimisée dans la procédure mini-invasive et on estime qu'elle a été réduite de moitié par rapport à la chirurgie ouverte. En outre, la satisfaction des patients à l'égard de la procédure laparoscopique mini-invasive sans complication était élevée conformément aux études cliniques randomisées (12). Une fuite s'est produite dans le bulbe duodénal chez deux des trois patients présentant une fuite d'œsophagojejunostomie. Une ampoule duodénale qui fuit, qui est l'une des complications les plus redoutées, est connue pour créer des fistules par contenu duodénal. Cela pourrait expliquer la guérison des tissus rouges lors de l'œsophagojéjunostomie. Cependant, cela soulève également la question de la suffisance de ne sceller que l'extrémité duodénale divisée avec une agrafeuse. Il pourrait dans notre cas être nécessaire de trop coudre le duodénum avec des sutures réabsorbables interrompues. La souffrance d'une complication majeure entraîne d'autres complications, comme en témoigne la fréquence élevée de complications mineures dans ces données préliminaires.
Nous avons choisi une anastomose agrafée linéaire pour l'œsophagojejunostomie et l'entéroanastomose. Cette technique présente plusieurs avantages par rapport à l'anastomose agrafée circulaire (13). Tout d'abord, il crée une anastomose significativement plus large. De plus, il exclut le problème d'un œsophage étroit ou de la suture de bourse souvent requise avec une anastomose agrafée circulaire. Nous n'avons eu aucune fuite deL'anastomose de Roux-en-Y, cependant, le taux de fuite de l'anastomose supérieure était élevé, soulignant les difficultés à faire l'anastomose supérieure. L'œsophage est connu pour avoir un apport sanguin insuffisant et il est important de ne pas disséquer trop haut dans le médiastin, ce qui va désvasculariser la partie distale de l'œsophage.
Tableau IV.Laparoscopique Total Gastrectomie: Complications Expérimenté.
Majeur, 6 patients | Fuite de l'anastomose de l'œsophagojejunal Fuite de l'ampoule duodénale Saignement postopératoire Hernie dans le hiatus œsophagien | 3 3 1 1 |
Mineure, 8 patients | Pneumonie Pneumothorax Arythmie cardiale Abcès abdominal | 5 1 4 2 |
La gastrectomie totale laparoscopique, qui est toujours une procédure controversée en ce qui concerne la survie à long terme, doit être considérée comme une procédure à haut risque et la sécurité chirurgicale doit être prise en compte. La gastrectomie totale laparoscopique est une procédure complexe et exigeante. La courbe d'apprentissage est longue et la performance de la procédure exige qu'elle soit centralisée dans les centres à fort volume. L'expérience japonaise suggère que cette procédure laparoscopique bénéficiera d'un programme d'éducation formalisé (14).
1 Kitano S, Iso Y, Moriyama M et Sugimachi K: Gastrectomie Billroth I assistée par laparoscopie. Endosc Surg Laparosc4: 146- 148,1994.
2 Kodera Y, Fujiwara M, Ohashi N, Nakayama G, Koike M, Morita S et Nakao A: Chirurgie laparoscopique pour le cancer gastrique: une revue collective avec méta-analyse d'essais randomisés. J Am Coll Surg211(5): 677-685, 2010.
3 Wei H, Wei B, Qi C, Chen TF, Huang Y, Zheng, Huang JL et Fang JF: LaparoscopiqueVersus Gastrottomie ouverte avec dissection des ganglions lymphatiques D2 pour le cancer gastrique: une méta-analyse. Surg Laparosc Endosc Percutan Tech21: 383-390, 2011.
4 Lee JH, Kim Y, Ryu KW, Lee JR, Kim CG, Choi IJ, Kook MC, Nam BH et Bae JM: un essai clinique de phase II de la gastrectomie distale assistée par laparoscopie avec dissection des ganglions lymphatiques D2 chez les patients atteints d'un cancer gastrique. Ann Surg Oncol14(11): 3148-3153, 2007.
5 Huscher CG, Mingoli A, Sgarzini G, Sansonetti A, Di Paola M, Recher A et Ponzano C: LaparoscopiqueVersus Gastrectomie sous-totale ouverte pour le cancer gastrique distal: résultats de cinq ans d'un essai prospectif randomisé. Ann Surg241: 232-237, 2005.
6 Hayashi H, Ochiai T, Shimada H et Gunji Y: Étude prospective randomisée de l'openVeRsus Gastrécérie distale assistée par laparoscopie avec dissection des ganglions lymphatiques extrapérigastriques pour un cancer gastrique précoce. Endosc Surg19: 1172-1176, 2005.
7 DECV. Lignes directrices cliniques nationales 2011. http:// gicancer.dk
8 Walther BS, Zilling T, Johnsson F, Stael von Holstein C et Joelsson B: Gastrectomie totale et œsophagojejunostomie avec des dispositifs d'agrafage linéaires. Br J Surg76: 909-912, 1989.
9 Zeng YK, Yang ZL, Peng JS, Lin HS et Cai L: Laparoscopie assistéeVersus Gastrectomie distale ouverte pour les preuves précoces du cancer gastrique provenant d'essais cliniques randomisés et non randomisés. Ann Surg256: 39-52, 2012.
10 Shinohara T, Kanaya S, Taniguchi K, Fujita T, Yanaga K et Uyama I: Gastrectomie totale laparoscopique avec dissection des ganglions lymphatiques D2 pour le cancer gastrique. Arche Surg144(12): 1138-1142, 2009.
11 Huscher CG, Mingoli A, Sgarzini G, Sansonetti A, Lirici MM, Napolitano C et Piro F: Gastrectomie totale et sous-totale videolaparoscopique avec dissection étendue des ganglions lymphatiques pour le cancer gastrique. Am J Surg188(6): 728-735, 2004.
12 Kim YW, Baik YH, Yun YH, Nam BH, Kim DH, Choi IJ et Bae JM: Amélioration de la qualité de vie après une gastrectomie distale assistée par laparoscopie pour un cancer gastrique précoce: résultats d'un essai clinique prospectif randomisé. Ann Surg248(5): 721-727, 2008.
13 Walther BS, Oscarson JEA, Graffner HO, Vallgren S et Evander A: Esophagojejunostomie avec l'agrafeuse EEA. Chirurgie99(5): 598-603, 1986.
14 H-K de Kitano S et Yang: gastrectomie laparoscopique pour le cancer. Springer Verlag, New York, ISBN 978-4-431-54002-1.
Reçu Mars 5, 2013Révisé Mai22, 2013Accepté Mai 27, 2013
This is the first one.
This is the last one.